实用免疫学(五)适应性免疫:细胞免疫一 Th细胞
Th0细胞通过表面黏附分子(T细胞表面的LFA-1、ICAM-1、CD2分别和APC的ICAM-1、LFA-1、LFA-3)和DC细胞发生短暂的可逆结合,有利于TCR特异性识别pMHCII(Ag-MHCII复合物)。
- TCR:有αβ和γδ两种,αβT占95%
由成簇的V、D、J基因节段以及恒定的C区基因间断排列而成
基因重组酶参与TCR基因片段重排,遵循类似Ig的12/23法则
TCRα和TCRβ都是位于T细胞膜上的类Ig结构,两条链通过细胞膜外的半胱氨酸残基形成的二硫键共价联合在一起 - 12/23法则
Ig胚系基因重组时,带有12bp的RSS只能和带有23bp的RSS结合,从而保证基因片段间的正确连接和重排 - TCR复合物
包含一个TCRαβ异二聚体,两个CD3γε和CD3δε异二聚体,以及一个通过二硫键相连的ξ同二聚体
TCRα和TCRβ都是位于T细胞膜上的类Ig结构,两条链通过细胞膜外的半胱氨酸残基形成的二硫键共价联合在一起(在TCRα和TCRβ链的恒定区后面连接着一小段Hinge结构,Hinge结构中存在半胱氨酸残基,两个半胱氨酸残基形成二硫键把两条链联系在一起)。每一条TCR的链包含一个类似免疫球蛋白的N末端可变区和恒定区,一个疏水的跨膜结构,以及一个非常短的胞内区域。总体来看,TCRαβ胞外区域的结构和抗体的抗原结合域(Fab)非常相似。TCRα和TCRβ链的可变区分别有3个类似于抗体可变区的互补决定区(CDR),这6个CDR共同形成了pMHC在TCR上的结合位点。
当Th0的TCR和pMHCII特异性结合后,CD4也随后和MHCII分子β2结构域发生结合,导致CD4在物理上靠近TCR复合物。
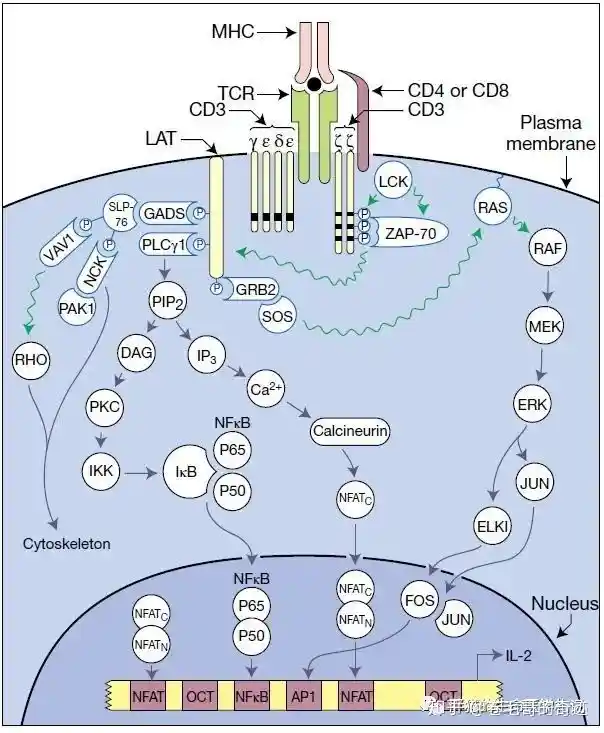
- CD4:TCR的共受体,在T细胞的激活过程中起到促进的作用
可以结合到MHCII分子上,同时识别pMHCII复合物,增强TCR复合物和DC的结合
在结构上CD4是一种跨膜的糖蛋白,属于Ig超家族。有四个细胞外的类Ig结构域,一个疏水的跨膜结构以及38个氨基酸长度的胞内结构域;胞外的两个类Ig结构域可以和MHC-II的α2和β2结合。
胞内结构域上附着结合着Src酪氨酸激酶家族的成员——Lck
伴随CD4靠近TCR复合物,在细胞内,CD4上的Lck分子和CD3、ξ上的ITAM靠近,随后Lck就将ITAM上的酪氨酸残基磷酸化,ITAM的磷酸化随后导致ZAP-70酪氨酸激酶的募集和活化,ITAM的结构中有两个酪氨酸残基,这两个酪氨酸残基被磷酸化以后可以和ZAP-70结合,结合上去的ZAP-70被Lck磷酸化。ZAP-70被磷酸化后获得它本身的酪氨酸激酶活性并进一步通过磷酸化作用,活化另外两个重要的衔接蛋白LAT和SLP-76,最终通过 Ras–MAP 和PLCγ1信号通路引发T细胞内一系列的下游通路,使得Th0细胞初步活化。
在某些下游通路的刺激下,多个TCR-pMHC向Th0和DC接触面的中央移动。在其中某个下游通路中,有LFA-1构象发生改变,增强ICAM-1的亲和力,从而稳定Th0与DC的结合。此过程最终会形成免疫突触的结构。
- 免疫突触:多个TCR-pMHC/CD4/CD28在中央,周围围绕着IFA-1-ICAM-1 等共刺激分子的相对密闭的突触状结构
增强 T 细胞和 APC 结合的亲和力;引发胞膜分子的一系列变化,促进信号转导、细胞骨架系统和细胞器的变化
Th0细胞初步活化的同时,DC也被激活,上调协同刺激分子B7,为Th0细胞进一步活化做准备
- B7分子:主要包括B7-1(CD80)和B7-2(CD86),主要表达于DC细胞。
B7分子与CD28分子结合产生的共刺激信号对Th0细胞的活化起重要作用,一方面通过诱导T细胞分泌抗凋亡蛋白,维持细胞的存活;另一方面刺激T细胞合成分泌重要的生长因子IL-2,促进T细胞的增殖和分化。 - CD28:表达于Th0细胞,由两条相同的肽链组成的同源二聚体
- IL-2:来自Th1,T细胞自分泌生长因子、B细胞旁分泌生长因子、激活NK细胞形成LAK
- LAK:淋巴因子激活的杀伤细胞,对肿瘤细胞具有特异的细胞毒性(可以裂解NK不能裂解的细胞)
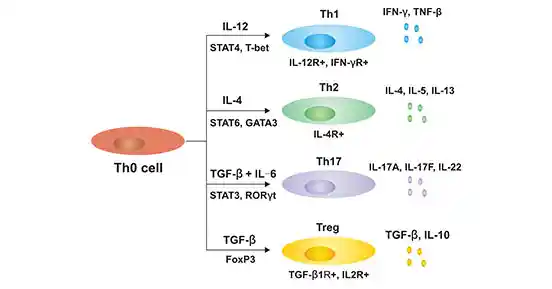
当CD28和DC表面的B7结合后,初步活化的Th0细胞开始分泌关键的IL-2,从G0期进入G1期,完成最后的激活。并在其他细胞因子的作用下,决定分化的方向:
Th1:分化主要由细胞因子IL-12和IFN-y诱导;主要通过分泌IL-2、IFN-γ,增强巨噬细胞的功能,介导抗胞内病原体的细胞免疫。参与慢性炎症和自身免疫疾病。
IL-12:来自DC;【早期】激活NK细胞分泌IFN-γ;【晚期】诱导Th1分化
IFN-γ:来自NK细胞、Th1;激活巨噬细胞;促进Th1分化,抑制Th2分化
Th2:分化主要由细胞因子IL-4诱导;主要通过分泌IL-4、IL-5、IL-13,促进B细胞分泌IgE、肥大细胞嗜酸性细胞嗜碱性细胞活化、介导抗寄生虫感染。参与过敏。
IL-4:来自Th2;刺激B细胞增殖、肥大细胞发育、IgE生成
IL-5:来自Th2;促进嗜酸性细胞生长、IgA生成
IL-13:来自Th2、CD4T、NKT、Mast、Baso、eosino、nuo,促进IgE生成、杯状细胞增生和分泌黏液,与过敏相关。
Th17:分化主要由TGF-β、IL-6诱导,主要分泌IL-17(A和F)和IL-22,促进中性粒细胞的招募和活化,介导多种急性和慢性组织炎症。参与自身免性疾病。
TGF-β:来自成纤维细胞;抗病毒作用、促进MHC分子表达
IL-6:来自巨噬细胞;诱导CRP合成、内生致热原
IL-17:来自Th17, 通常被称为 CTLA8,趋化因子
IL-22:来自Th1、Th2、Th17、γδT、NKT、ILC3、neutro、macro,作用于非造血细胞,刺激细胞存活、增殖和抗菌剂的合成,参与伤口愈合和抗感染
ILC3:来自淋巴谱系的免疫细胞,参与粘膜的先天机制,有助于组织稳态、宿主共生共生和病原体清除。
Th细胞迁移到外周组织、遇到抗原并发生二次活化(仅CD3、ξ活化信号即可),从而发挥其具体的效应。
Th细胞迁移至感染部位与归巢表型相关
- Th1:选择素配体、CXCR3、CCR5
- Th2:CCR3、CCR4、CCR8
- Th17:CCR6
Th1细胞的效应
Th细胞本身并不直接杀伤和清除病原体,而是通过分泌细胞因子和表达细胞表面分子,活化其他免疫细胞,增强其效应功能,从而清除病原体。
通过分泌细胞因子,介导中性粒细胞、单核细胞和嗜酸性粒细胞到达感染部位
通过分泌细胞因子和表达CD40L两种主要机制活化白细胞
诱导并募集巨噬细胞:Th1细胞产生IL-3和GM-CSF,促进骨髓造血干细胞分化为单核细胞;产生TNF-α、LTα和CCL2,诱导炎症部位血管内皮细胞高表达黏附分子,促进单核细胞和淋巴细胞的血管内皮黏附,继而穿越血管壁趋化到局部组织
激活巨噬细胞:Th1产生IFNγ,表达CD40L与巨噬细胞表面的CD40结合,导致转录因子NF-κB和AP-1的激活,促进巨噬细胞的吞噬溶酶体表达多种蛋白酶和溶解酶,诱导ROS和iNOS产生,后者可刺激一氧化氮的合成,最终杀伤巨噬细胞吞噬的微生物。IFNγ、CD40L激活的M1型巨噬细胞具有强大的杀菌能力,同时也通过高表达B7和MHCII类分子,从而具有更强的呈递抗原和活化CD4+T细胞的能力,分泌的 IL12、IL1、TNF等细胞因子,可促进Th1细胞分化,并进一步招募白细胞到达感染组织
当病原体能有效抵抗活化巨噬细胞的杀菌作用时,会发生慢性感染炎症,例如慢性结核分歧杆菌感染的特征性标志肉芽肿就是Th1细胞活化巨噬细胞引起的组织病理改变
而当CD4+T细胞缺失时,不能有效激活巨噬细胞,如HIV感染的患者常死于卡氏肺囊虫感染引发的肺炎,而M1型巨噬细胞能吞噬并杀伤清除卡氏肺囊虫
Th1产生的LT和TNFα可活化中性粒细胞,促进其杀伤病原体。但活化的巨噬细胞和中性粒细胞分泌的杀菌分子,不区分微生物和宿主组织,可造成正常组织的损伤。不过感染清除后可以通过组织修复而恢复
Th1产生IFNγ作用与B细胞,促进抗体类型转化为IgG,且抑制IL4依赖的IgE类型转化
产生的IF2可促进CTL分化,激活的M1高表达的B7分子可作为第二信号活化CTL细胞